カールフィッシャー水分測定装置(水分計)の原理
カールフィッシャー法とは
カールフィッシャー法は、1935年にドイツの化学者カール・フィッシャーによって発見された、滴定による水分測定方法です。ある試薬を用いることにより、よう素と水とが選択的に反応することを発見。発見者の名前から、この試薬をカールフィッシャー試薬と呼ぶようになりました。
カールフィッシャー法には、大きく分けて2つの方法があります。
1つ目は、「容量滴定法」(もしくは容量法)です。これは、カールフィッシャー試薬を滴加して測定する方法で、終点までに滴加した試薬の容量から水分量を求めます。
2つ目は、「電量滴定法」(もしくは電量法)です。これは、カールフィッシャー試薬を応用した電解液を用いる方法です。あらかじめ密封された測定セルへこの試薬を入れておき、試料を加えます。次に、加えた試料に含まれる水分量に応じて「電気分解」により電解液から「よう素」を発生させて、反応の終点とします。これに要した電気量(「よう素」の発生量)から水分量を換算して求めます。
カールフィッシャー容量滴定法の測定原理
カールフィッシャー法の化学反応式をあげて説明します。
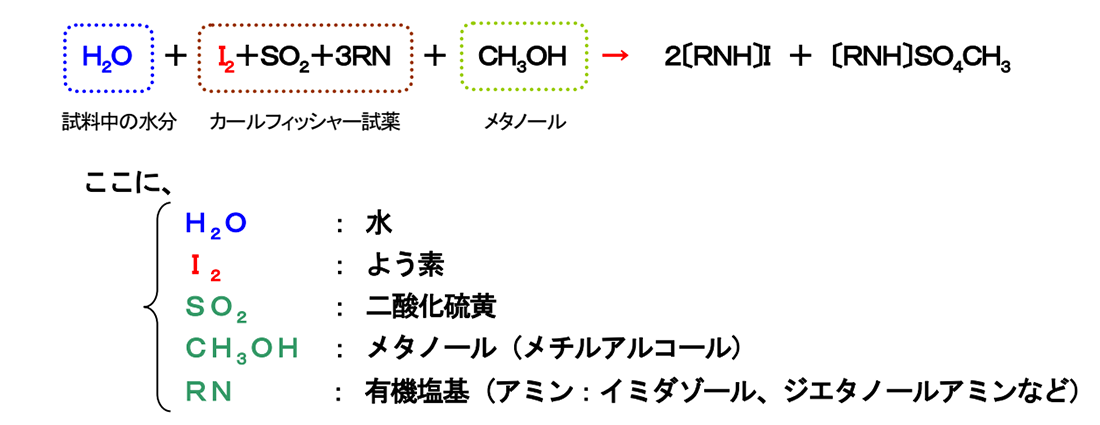
矢印の右側の反応後の式には、水(H2O)の姿がありません。水は反応で消費されてしまうのです。式のように水とよう素は一定の割合(1:1)で反応します。
試料に含まれる水分の量を濃度(%)で表すと、次のような計算式になります。

“試薬の力価”とは、1mLのカールフィッシャー試薬が反応できる水分の量(mg)と考えると、理解しやすいかと思います。 力価の単位(mgH2O/mL)に注目してください。試薬量(1mL)についての水分量(mg)を示しています。 この“力価”を、反応が終了(終点)になったところまで加えた試薬の量“滴定値(mL)”にかけることで、水分量をmg単位で求めることができます。 得られた水分量(mg)を、さらに試料全体の重さ(*)で割り、100をかけることで水分量として%単位で求めることができます。
(*):試料量をmg単位とするために1000をかけています。
カールフィッシャー電量滴定法の測定原理
電量法においても水分を消費するために用いられる反応は、容量法と同じカールフィッシャー反応です。
異なる点は、カールフィッシャー試薬の一成分であるよう素(I2)が最初から含まれるのではなく、電気分解によって生成され、カールフィッシャー反応に供給される点です。電量法では、カールフィッシャー試薬の“よう素(I2)”の代わりに、“よう素イオン(2I-)”が含まれています。
2I-+ SO2+3RN : 電解液(発生液)
この“よう素イオン(2I-)”を、電解により酸化することで電子(2e-)を引き抜くと
2I- → I2 + 2e-
となり、よう素イオンは“よう素”になります。生成したよう素は直ちにカールフィッシャー反応に供給されて、水と反応します。
これにより、容量法の反応式におけるカールフィッシャー試薬と同じになり、電量法においても同じ反応であることがわかります。
※電量法で用いる電解液(発生液)は、あらかじめメタノールを加えてあるものもあります。
電解によって発生する“よう素”は、『ファラデーの法則』にしたがい、電気量に比例します。
水とよう素の反応は1:1であり、よう素1モルを生成するためには電子2モルが必要となります。
電子1モルに相当する電気量はファラデー定数により96485クーロン、水1モルは18.02gですので、水1mgは、(96485×2)/(18.02×1000)=10.71クーロンに相当します。
これにより、試料に含まれる水分の量を割合(%)で表すと、次のような計算式になります。

【参考】10.71クーロンは、電流107.1mAを
100秒間流した電気量
反応が終了(終点)になったところまで加えた電気量を求め、上の式に当てはめることで水分量を求めることができます。 式の分数部の分子部分において、要した電気量を水1mg相当の電気量で割ることで、水の量がmg単位で求めることができます。さらに、試料全体の重さ(*)で割り、100をかけることで水の割合として%単位で求めることができます。
(*):試料量をmg単位とするために1000をかけています。
測定原理、その他の説明は、一般的な内容による説明であり、実際のものとは異なる場合があります。
カールフィッシャー試薬などは、試料に応じた組成、装置に応じた組成などのものがありますので、あらかじめご了承ください。


